
SMART101 de SMART IMMUNE
Le Centre MEARY intervient dans la production du médicament SMART101, développé par la société Smart Immune, dans le cadre de deux essais cliniques de phase I/II.
Ces essais évaluent la sécurité et l'efficacité de SMART101 dans l'accélération de la reconstitution immunitaire pour lutter contre les infections et la rechute après allogreffe de cellules souches hématopoïétiques.
Phases du projet
A propos
Smart Immune est une société de biotechnologie de stade clinique qui développe ProTcell, une plateforme de progéniteurs de cellules T thérapeutiques, qui utilise le pouvoir du thymus pour réarmer complètement et rapidement le système immunitaire, rendant ainsi possible la mise au point d’une nouvelle génération de thérapies allogéniques pour tous. La société vise à améliorer le pronostic vital de patients atteints de cancers du sang à haut risque ou d’immunodéficiences primaires.
Smart Immune collabore actuellement avec des institutions de premier plan aux États-Unis et en Europe. Les progéniteurs de lymphocytes T ProTcell font déjà l'objet de trois essais cliniques de phase I/II visant à accélérer le rétablissement complet du système immunitaire chez les patients qui reçoivent une allogreffe de cellules souches et luttent contre le cancer et les infections.
Smart Immune développe également des thérapies utilisant des progéniteurs de cellules T modifiés génétiquement par le biais de sa plateforme ProTcell afin de fournir des traitements ciblés contre le cancer ou le SIDA, comme des CAR-T persistantes prêtes à l’emploi ou des cellules T résistantes au VIH.
À propos du médicament SMART101 et de la plateforme ProTcell
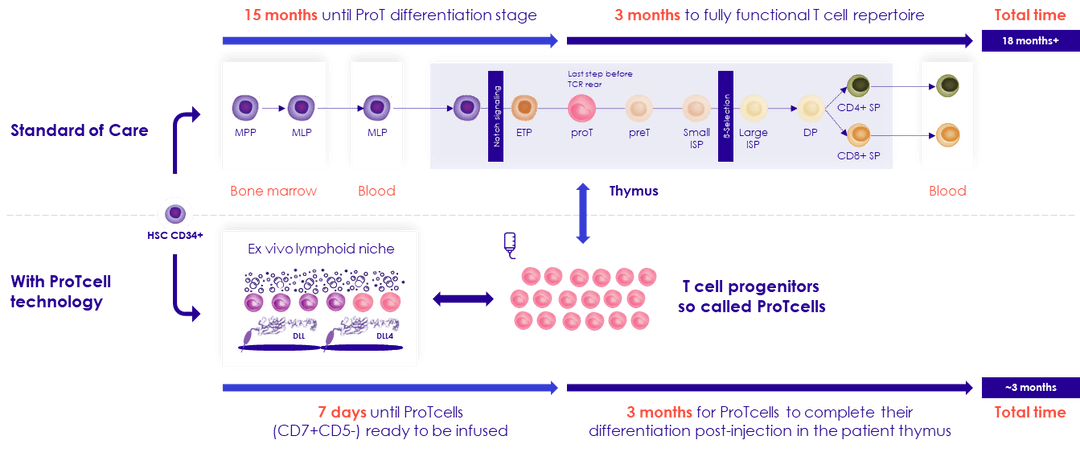
SMART101 est fabriqué ex-vivo en 7 jours à partir de cellules souches périphériques allogéniques, à l'aide de la plateforme ProTcell de Smart Immune. Une fois injectés au patient, les progéniteurs de cellules T humaines SMART101 migrent vers le thymus où ils sont éduqués pour devenir des cellules T pleinement fonctionnelles et autotolérantes.
Les données précliniques suggèrent que ces progéniteurs pourrait reconstituer le système immunitaire en 100 jours au lieu des 12 à 18 mois habituellement observés dans la physiologie, protégeant ainsi les patients des infections et des rechutes.
SMART101 est produit dans le cadre de deux essais cliniques par le Centre MEARY de l’AP-HP, partenaire de développement de Smart Immune en France. Dans le cadre de ce partenariat, l'AP-HP participe à la mise à l’échelle clinique de la production d’un tel médicament, le but étant pour la société Smart Immune de pouvoir traiter un maximum de patients en optimisant le procédé de production de ces cellules.
L'essai de phase I/II (NCT04959903)
L'essai de phase I/II (NCT04959903) est une première étude autorisée par la Food and Drug Administration (FDA). C'est une étude multicentrique, en ouvert, qui devrait inclure jusqu'à 36 patients adultes et pédiatriques atteints d'hémopathies malignes. Elle a été conçue pour évaluer la sécurité et le potentiel de SMART101 pour améliorer les résultats cliniques de la transplantation de cellules souches hématopoïétiques.
Le premier patient inclus a reçu une injection de SMART101 en décembre 2022.
L'essai de phase I/II (NCT05768035)
Un second essai, européen, de phase I/II (NCT05768035) incluant 34 patients adultes permettra également d’évaluer la sécurité et l’efficacité de SMART101 dans le cadre de greffes haplo-identiques de cellules souches hématopoïétiques.
